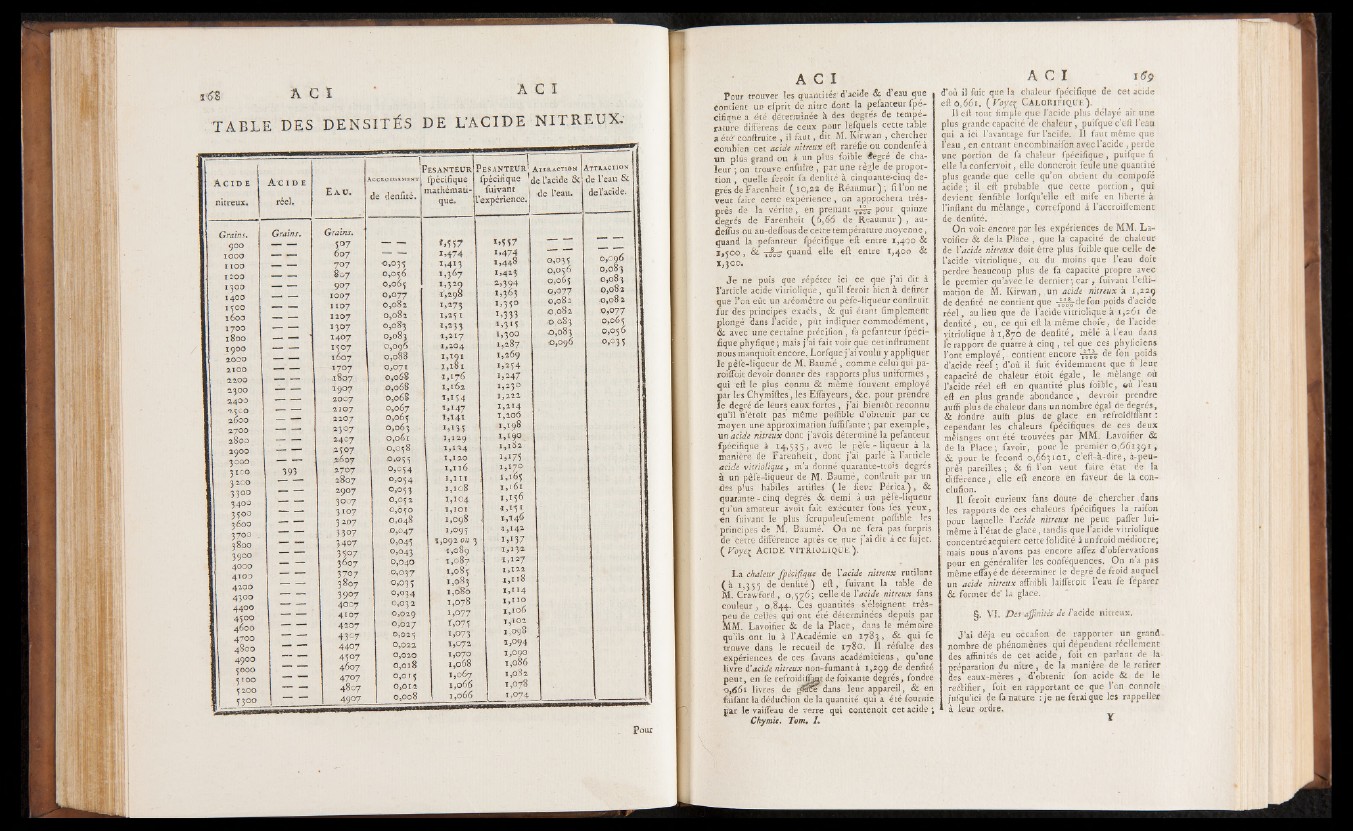
TABLE DES DENSITÉS DE L’ACIDE NITREUX
A c i de I A c ide
nitreux, j réel.
Grains.
900
1000
1100
1200
1300
1400
1500
1600
1700
1800
1900
2000
2100
2200
2300
2400
2500
2000
2700
2800
2900
3000-
3 ICO
3200
3300
3400
35° °
3600
3700. >
3800
3900
4000
4100
4200
4300
4400
4500
4600
4700
4800
4900
5000
,5100
5200
5300
Grains.
393
Grains.
I07
70 7
807
9 °7
1007
1107
1207
1307
1407
î ’) °7
1007
- -1707
1807
1907
2007
2107
2207
2307
2407
2507
2'6©7
2707
2807
2907
3007
3io 7
3207
3307
3407
3307
3697
3707
3807
3907
4007
4107
4207
4307
4407
4507
4607
4707
4807
49°7
[Pesanteur Pesanteur- attraction
accroissement! fpécifique fpécifique ^ l’acide &
mathémari-l fuivant
de denfité. {l’expérience.
-0,035
0,050
0,005
0,077
0,082
0,082
0,083
0,083
0,690,
0,088
0,071
0,068
0,068
0,068
0,067
0,065
0,063
0,061
0,058
0,055
0,054
0,054
0,053
0,052
0,650
0,048
0,047
0,045
0î°43
0,040
0,037
0,035
0,034
0,03 2
0,029
0,027
©,025
0,022
0,020
0,018
0,015
0,012
0,008
que.
de l’eau.
A t t r a c t io n
de l’eau &
de l’acide.
M 57
M 7 4 .
1,4^3 1,367
m m
1,298
1• ,>2»57 3I
1 ,2 3 3
1,2 Ï7
1,204
I , 191
J , lo i 1,176
I.,i62
1,154
ï.,147
1,141
1,124
1,120
I , 116
J , I I I
1,108
1,104.
1,101
1,098
ï ,©95
1,092 OM 3
■ 1,089 B 11,,008857
■ 1,083
I,68o 1,078
1,077
^075 1,073
I ,072
1,07° I,o68
1,067 1.066
1.066
*»557
i >474
1,448
1,423
a,3 94
1,363
i , 35°
ï ,333
1,3 m
1,300
1,287
1,269
i ,a .54
1,247
1,230?
1,222
1,214
1,206
1,198
1,190
l , i 82
1,175
1,1,70.
1,165
1,161
1,156
m1
,140
1,14a
37
3.2
1,1
B p
1,127
1,122
1,118
1,114
1,110
1,106
T,-102
1,098
1,094
1,090
1^086
1,082
1,078
1,074
0,035
0,056
0,065
0,077
0,0.8 2
0,082
0,083
0^083
0,096
0,096
0,083
0,083
0,082
0,082
0,077
0,065
0,056
0,035
Po
Pour trouver les quantités' d’acide & d’eau que
contient un efprit de nitre .dont la pefanteur fpe-
cifiqne a été déterminée à des degrés de température
différens de ceux pour lefquels cette table
a été'conftruite , il faut, dit M. Kirwan , chercher
combien cet acide nitreux eft raréfié ou condenfé à
un plus grand ou à un plus foible degre de chaleur
; on trouve enfuite , par une règle de proportion
, quelle feroit fa denfité à cinquante-cinq degrés
de Farenheit (10,22 de Réaumur); fi l ’on ne
veut faire cette expérience , on approchera très-
près de la vérité , en p r e n a n t p o u r quinze
degrés de Farenheit (6,66 de Réaumur) , au-
defliis ou au-deffous de cette température moyenne,
quand la pefanteur fpécifique eft entre 1,400 &
1,500, & -ïfïz quand elle eft entre 1,400 &
*,300. ■
j e ne puis que répéter ici ce que j’ai dit à
l ’article acide vitriolique, qu’il feroit bien à defirer
que Pon eût un aréomètre ou pèfe-liqueur conftruit
fur des principes exaéts, & qui étant Amplement
plongé dans l’acide, pût indiquer commodément,
& avec une certaine précilion, fa pefanteur fpécifique
phyfique ; mais j’ai fait voir que cetinftrument
nous manquoit encore..Lorfque j ’ai voulu y appliquer
le pèfe-liqueur de M. Baumé , comme celui qui pa-
roiffôit devoir donner des rapports plus uniformes ,
qui eft le plus connu & même fouvent employé
par les Cbymiftes, les Effayeurs, &c. pour prendre
le degré de leurs> eaux fortes , j ’ai bientôt reconnu
qu’il n’ëtoit pas même poffible d’obtenir par ce
moyen une approximation fuffifante ; par exemple,
un acide nitreux dont j’avôis déterminé la pefanteur
fpécifique à 14,535 , avec le pèfe-liqueur à la
manière de Farenheit, dont j ’ai parlé à Farticle
acide vitriolique, m’a donné quarante-trois degrés
à un pèfe-liqueur de M. Baumé, conftruit par un
des plus habiles artiftes ( l e fieu.r Périca), &
quarante - cinq degrés & demi à un pèfe-liqueur
qu’un amateur âvoit fait exécuter fous fes yeux,
en fuivant ïe plus'fcrupuleufement poffible les
principes de M. Baumé. On ne fera pas furpris
de cette différence après ce_ que j’ai dit à ce fujet.
{Voyez A cide v it r io l iq u e ).
La chaleur, fpécifique de Y acide nitreux rutilant
( à 1,355 de denfité ) eft , fuivant la table de
M. Crawford, 0,576; celle de Y acide nitreux fans
couleur, 0,844. Ces quantités s’éloignent très-
peu de celles qui ont été déterminées depuis par
MM. Lavoifier & de la Place, dans le mémoire
qu’ils ont lu à l’Académie en 1783 , & qui fe
trouve dans le recueil de 1780. il., refui te des
expériences de ces favans académiciens, qu’une
livre acide nitreux non-fumant à 1,299 de denfité
peut, en fe refroidiffiyitdefoixante degrés, fondre
o,(561 livres de gî?rce dans leur appareil, & en
fâifant la déduélion de la quantité qui a été fournie
jiar le vaiffeau de verre qui contenoit cet acide ;
Chymie. Tom• /.
d’où il fuit que la chaleur fpécifique de cet acide
eft 0,661. {Voyez C a lo r if iq u e ).
11 eft tout fimple que l’acide plus délayé ait une
plus grande capacité de chaleur , puifque c’eft l’eau
qui a ici l’avantage fur l’acide, i l faut même que
l’eau , en entrant en combinàifôn avec l’acide , perde
une portion de fa chaleur fpécifique, puifque fi
elle la confervoit, elle donneroit feule une quantité
plus grande que celle qu’on obtient du coiflpofé
acide ; il eft probable que cette portion , qui
devient fenfible lorfqu’elle eft mife en liberté à,
l’inftant du mélange, correfpond à l’accroiftement
de denfité.
On voit encore par les expériences de MM. Lavoifier
& de la Place , que la capacité de chaleur
de Y acide nitreux doit être plus foible que celle de
l’acide vitriolique, ou du moins que l ’eau doit
perdre beaucoup plus de fa capacité propre avec
le premier qu’avec le dernier; car , fuivant l’efti-
mation.de M. Kirwan,.un acide nitreux à 1,229
de denfité ne contient que defon poids d’acide
réel, au lieu que de l’acide vitriolique à 1,261 de
denfité, ou, ce qui eft la même chofe, de l’acide
' vitriolique à 1,870 de denfité, mêlé à l’eau dans
le rapport de quatre à cinq , tel que ces phyficiens
l’ont employé, contient encore ~ ~ de fon poids
d’acide réel ; d’où il fuit évidemment que fi leur
capacité de chaleur étoit égale, le mélange^ où
l’acide réel eft en quantité plus foible, où l’eau
eft en plus grande abondance , devroit prendre
auffi plus de chaleur dans un nombre égal de degrés,
& fondre auffi plus de glace en refroidiffant :
cependant les chaleurs fpécifique» de ces deux
mélanges ont été trouvées par MM. Lavoifier &
d elà Place; favoir, pouf le premier 0,661391,
& pour le fécond .0,663101, c’eft-à-dire, à-peu-
près pareilles ; & fi l’on veut faire état ' de la
différence, elle eft encore en faveur de la con-
clufion.
Il feroit curieux fans doute de chercher ï dans
les raoports de ces chaleurs fpécifiques la raifon
pour laquelle Y acide nitreux 11e peut paffer lui-
même à l’état de glace, tandis que l’acide vitriolique
concentré acquiert cette folidité à un froid médiocre;
mais nous n’avons pas encore affez d’obfervations
pour en généralifer les conféquences. On n’a pas
même effayé de déterminer le degré de froid auquel
un acide nitreux affoibli laifferoic l’eau fe féparer
& former de' la glace.
§. VI. Des affinités de F acide ni creux.
J ’ai déjà eu occafion de rapporter un grand
nombre de phénomènes qui dépendent réellement
des affinités de cet acide, foit en parlant de la
préparation du nitre, de la manière de le retirer
des eaux-mères , d’obtenir fon acide & de le
reélifier, foit en rapportant ce que l’on connoît
jufqu’ici f e fa nature : je ne ferai que les rappelle*
à leur ordre.
Y